孕早期细胞的变化对于妊娠成功至关重要,为什么母亲的免疫系统不会攻击发育中的胎儿。

2018年11月15日,外国的联合研究团队,测序7万个孕早期胎盘了单细胞RNA,展现了母胎界面的单细胞图谱。数据结果更是是史无前例的,细胞间通讯网络表明,胎盘与母体免疫系统相连的细胞负责胎盘的正确植入,因而才能保证胎儿正确生长和发育。

图1. 括号中的数字表示被分析的个体数量,蜕膜、胎盘和母体外周血单核细胞的单细胞转录组分析工作流程。
研究人员使用Illumina测序平台、10x Genomics Chromium液滴系统和Smart-Seq2技术分析了细胞之间的关系,并用统计学方法来解释关系的机理。用显微镜检查胎盘细胞之间的相互作用以及母体和胎儿组织界面中胎盘细胞间的相互作用,转录组测序其中包括11个蜕膜样本、5个胎盘样本以及6个正常血液样本,图1。

图2.节点代表细胞集群,边缘线表示重要配体-受体配对的数量。蜕膜(左)与胎盘(右)内的潜在相互作用。
细胞之间讯息传递
一个储存这些数据的开放式数据库建立,以便于追踪细胞的特异性表达,同时还可预测分析不同细胞类型之间的分子相互作用。研究人员在蜕膜和胎盘中构建了一个潜在的细胞-细胞通讯网络,分析了每个细胞类型中配体和受体的表达水平,并凭借经验去统计有哪些配体和受体会产生显著的细胞类型特异性,而这种特定的细胞类型可以预测细胞群之间的分子相互作用,如图2及图3。
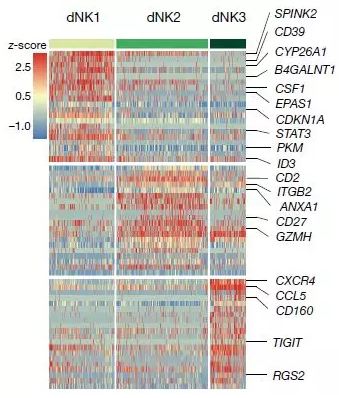
图3. 定义三个dNK子集相对表达的热图
三种蜕膜NK细胞
研究人员定义三种NK细胞亚基dNK1、dNK2、dNK3,它们共同表达CD49A和CD9。通过流式细胞分选与吉姆萨染色等实验,与dNK2和dNK3细胞相比,dNK1细胞含有更多的胞浆颗粒;同时,dNK1细胞含有更多的有关糖酵解相关的酶,dNK1细胞可以识别并应答EVT细胞(绒毛外滋养细胞)。首次怀孕与NK细胞表达低水平的LILRB1有关,数据表明首次怀孕与dNK1细胞的启动有关,对于进一步的胎盘植入更为重要。
妊娠早期免疫调节
dNK1细胞表达更高水平的CSF1,CSF1在EVT与巨噬细胞中表达的受体。相反,dNK2和dNK3细胞表达高水平的XCL1和CCL5,CCR1为CCL5的受体,主要负责调节EVT的入侵。XCL1-XCR1配基与受体复合物的表达模式可以代表着dNK2与dNK3;EVT与DC1之间的关系,DC1的招募是由自然杀伤细胞调节的。蜕膜CD8+T细胞的扩增可能由于DC1水平的上调,但是PD1的共表达又暗示着T细胞激活受限。
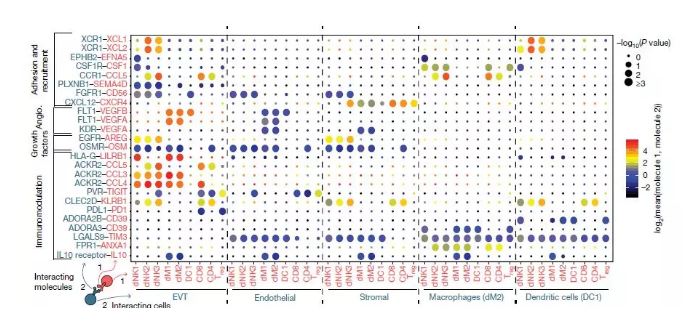
图4. 配体与受体相互作用的概述:通过分析mRNA水平来推测蛋白分子的相互作用
与此同时,研究人员还预测蜕膜的免疫微环境可以防止炎症反应,而这种炎症反应是由滋养细胞侵袭和滋养层的螺旋动脉的平滑肌间质损伤引起的。蜕膜巨噬细胞的亚群表达一些免疫调节分子,如IL10,一种由EVT细胞、母体内皮细胞、间质细胞以及骨髓细胞表达的受体。dNK2和dNK3表达高水平的ANXA1,dNK1细胞表达更高水平的SPINK2,都编码与抗炎症有关的蛋白。dNK1能够表达CD39,CD39与CD37共同将ATP转化为腺苷,从而阻止免疫激活。腺苷的受体ADORAS在巨噬细胞中表达,CD73在上皮腺和EVT中的表达很高,如图5。

图5. 参与免疫调节的三个dNK亚群上主要受体和配体相互作用示意图
此前,其他研究人员看到了妊娠早期绒毛外滋养层细胞的抗炎活性向滋养细胞过渡,这表明这些过渡细胞随着妊娠反应侵袭性也越强。
对癌症领域也有一定意义
此前研究数据显示,育龄女性的流产发生率在10%~15%之间,子痫前期等妊娠疾病的发生都与胎盘异常有关,胎盘中多种表观遗传修饰能够影响胎盘的正常功能。在怀孕期间,一些病毒的入侵会使免疫反应受限,此次研究阐明了母胎界面是如何受到免疫反应的抑制。此外,该研究对癌症领域也有一定意义。肿瘤细胞可以利用类似的机制逃避免疫系统,提取新鲜血液供其生长。