CRISPR基因编辑技术主要是通过细胞内DNA双链断裂(DSB)的定点诱导及随后的修复来实现,其中可利用的一条主要修复途径是非同源末端连接(NHEJ)。由于CRISPR/Cas9介导的常规基因敲除效率高,且依赖于突变型NHEJ,修复CRISPR/Cas9诱导的DSB的NHEJ常被认为是易错的。
然而,Cas9诱导的DSB主要是平末端,不需要额外的末端加工就可以直接相连,浙江大学医学院附属邵逸夫医院及转化医学研究院谢安勇研究组推测,CRISPR/Cas9诱导的NHEJ修复应该是偏向精准型的,而且这个偏向性或许可以帮助提高CRISPR/Cas9基因编辑的效率及精准度。尽管作者先前的研究已显示,可直接相连的DNA末端,包括Cas9 诱导产生的平末端,可以通过精准型NHEJ高效修复[1,2],但研究只局限于个别基因组位点,还未在多个位点上进行系统验证及分析,其中的规律也不明了。
为解决这个问题,该研究组设计了配对sgRNA靶向小鼠和人基因组的71个位点,引导Cas9在这些靶点上诱导两个邻近的DSB。这两个临近的DSB可以同时或分别产生:同时产生的DSB归类于Group I,只产生第一个DSB的为Group II,只产生第二个DSB的为Group III,两个DSB分别产生的为Group IV(图1a)。这些类型的DSB被NHEJ修复之后,通过靶点序列PCR扩增子深度测序,结合研究组开发的生信分析软件,可以计算不同类型修复产物频率,鉴定修复特征。在Group I DSB的修复中,无论NHEJ是精准型还是突变型,都将导致间隔序列丢失,因此通过分析接口序列可以将精准型NHEJ从突变型中区分开来。
结果显示,70个基因组位点总基因编辑效率(即NHEJ修复频率)平均约为35.8%,其中大约60%为Group I NHEJ产物,而Group I NHEJ产物中精准型NHEJ比例平均约50%(图1b),并且在很多位点上精准型NHEJ甚至超过80%。以上结果表明,修复Cas9产生的DSB的NHEJ途径偏向精准型NHEJ。正因为配对Cas9-sgRNA策略可以区分精准型NHEJ和突变型NHEJ,该方法还可以取代常用的NHEJ报告系统,用于定量分析细胞内和动物体内的NHEJ,而且更方便、更灵活。
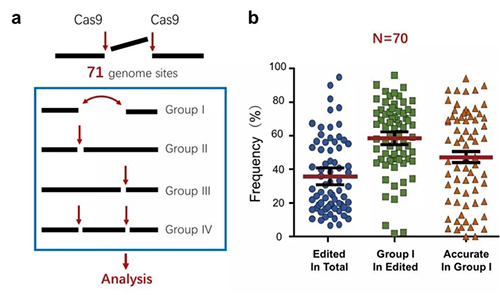
图1. 配对Cas9-sgRNA技术在71个内源基因组位点的NHEJ分析。a. 配对Cas9-sgRNA诱导的NHEJ产物(基因组编辑)示意图。b. 70个基因组位点的总编辑效率、Group I NHEJ效率及精准型NHEJ效率。额外的1个位点只能计算精准型NHEJ效率而未被包括在内。
课题组还注意到,在所分析的70个位点中,有的位点精准型NHEJ频率极低,甚至不超过20%(图1b),这样的现象通常被认为是受末端加工导致核苷酸丢失(即删除)影响所致。然而,分析显示,在修复Cas9诱导的DSB时,低频精准型NHEJ主要伴随的是高频核苷酸插入,而且这些核苷酸不是随机的,而基本都是由模板序列决定的核苷酸插入,称模板化插入(TI)(图2a)。先前的研究已表明,Cas9的RuvC和HNH核酸酶结构域通常在PAM(protospacer adjacent motif)前第3位碱基切割,产生平末端,但RuvC有时在第4位或第5位碱基切割,产生带1个或2个核苷酸(nucleotides,nt)外伸端的5’粘性末端[3]。
此时,由于Group I DSB的两个5’粘性末端有极小的互补概率,细胞难以通过精准型NHEJ修复,而是通过DNA聚合酶将粘性末端补平,在连接时就会产生+1核苷酸或+2核苷酸的模板化插入[4]。这些模板化插入的频率与精准型NHEJ发生频率成负相关,即精准型NHEJ的效率越低,模板化插入比例越高(图2b)。也因为这个原因,配对Cas9-sgRNA策略所得出的精准型NHEJ频率低估了修复Cas9诱导的单个DSB的精准型NHEJ效率。

图2. 71个基因组位点模板化插入对精准型NHEJ效率的影响。a. +1 nt插入效率与+1 nt模板化插入效率几乎完全正相关。b. +1 nt和+2 nt模板化插入效率与精准型NHEJ效率呈负相关。
那么,是否可以通过避免模板化插入提高精准型NHEJ的效率呢?根据模板化插入产生的原理,配对Cas9-sgRNA在靶点上的特定定位应该可以避免模板化插入。Cas9-sgRNA在靶点上的定位由PAM决定,PAM 基序既可以在Watson链(即W)上,也可以在Crick链(即C)上。因此,配对Cas9-sgRNA在靶点上的位置可以排列出四种组合:W/W、W/C、C/W和C/C(图3a)。如果Cas9产生的DSB是平末端,修复产物不会有高频的模板化插入;只有当Cas9产生5’外伸端时通过DNA聚合酶补平才会产生模板化插入。
然而,在W/C位置组合中,前后两个DNA末端的5’外伸端补平后相当于Cas9切割产生的平末端,可以预测修复完成后不会有额外的模板化插入,而其它三种组合(W/W、C/W和C/C)则会产生(图3a)。结果正如预期,通过对71个基因组位点的分析,配对Cas9-sgRNA为W/C位置时,几乎检测不到模板化插入(图3b),而且精准型NHEJ效率最高(图3c)。这一结果提示在使用配对Cas9-sgRNA基因编辑技术时,尽可能选择“W/C”位置组合以期获得最高效率的精准型NHEJ修复事件。
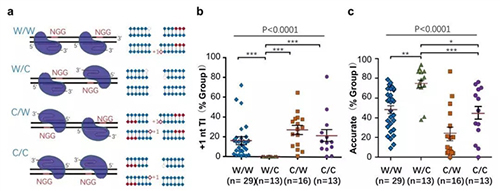
图3. 配对Cas9-sgRNA的PAM组合对精准型NHEJ的影响。a. 根据配对Cas9-sgRNA在靶点上的PAM位置产生的四种组合。b. 配对Cas9-sgRNA的PAM组合对模板化插入产生的影响。W/C组合几乎不产生模板化插入。c. 配对Cas9-sgRNA的四种PAM组合对精准型NHEJ效率的影响。W/C组合产生更高效的精准型NHEJ。
由于配对Cas9-sgRNA的在靶点上的切割间距可以设置为移码的3n+1或3n+2碱基对(n为0或大于0的整数),高效的精准型NHEJ理论上可以帮助提高移码突变频率。为了明确配对Cas9-sgRNA策略在基因敲除(即移码突变)中是否比传统的CRISPR/Cas9方案更有效,作者将编辑中产生的四种NHEJ产物(即上述的Group I、II、III和IV产物)进行重新归类和计算,比较这些产物对移码突变效率的影响。配对Cas9-sgRNA策略(即“Paired”策略)最理想状态只产生Group I产物(即“Ideal”),而传统的双sgRNA基因敲除技术(即“Common”策略)没有Group I NHEJ,只是Group II、III和IV事件的总和(图4a)。
通过对其中50个产生移码突变的位点进行分析,作者发现,一旦精准型NHEJ频率超过29.8%,“Paired”策略比“Common”策略在移码突变编辑时更有效,而且,精准型NHEJ频率越高,移码突变频率提高的越高,但都低于“Ideal”状态(图4b)。考虑到绝大部分位点的精准型NHEJ效率都超过29.8%,可以认为配对Cas9-sgRNA策略总体上比传统基因敲除技术更有优势。同时,由于特定长度精准删除的基因敲除产物将增加,基因敲除的同质性也随之提高,这有利于挑选等位基因精准移码突变的细胞克隆。
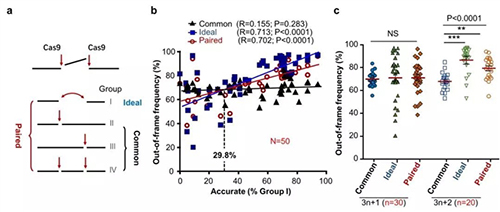
图4.配对Cas9-sgRNA技术可以提高基于移码突变的基因敲除编辑。a. 配对Cas9-sgRNA编辑产物分组示意图。配对Cas9-sgRNA编辑产物可分成最理想的“Ideal”、传统策略“Common”和配对策略“Paired”三组。标注的Group I、II、III及IV分布于各组。b. 精准型NHEJ频率与移码突变效率正相关。c. 基于精准型NHEJ的“3n+2”碱基对删除,而不是“3n+1”碱基对删除,在平均水平上可提高移码突变频率。
此外,当配对Cas9-sgRNA的切割间距设置为3n+1碱基对时,高频的+1核苷酸模板化插入会将3n+1的移码突变转变为3n的整码突变,基因敲除效率会因此受影响。然而,如果配对Cas9-sgRNA的切割间距为3n+2时,即使高频的+1核苷酸模板化插入也只是将3n+2的移码突变转变为3n+1,移码突变的效率不受影响,配对Cas9-sgRNA基因敲除技术的效果仍优于传统CRISPR/Cas9基因敲除技术(图4c)。
基因编辑中也常应用到整码删除或整码突变,比如整码删除基因的特定功能区域。既然配对Cas9-sgRNA的切割间距可以设置为3n碱基对(n为大于0的整数),是否可以利用高效的精准型NHEJ修复实现高效精准的整码删除呢?作者于是分析了配对Cas9-sgRNA策略介导的20个整码突变位点。结果显示,传统基因编辑技术(即“Common”技术)将整码突变效率维持在33%左右,而“Paired”配对策略明显优于“Common”技术(图5)。其介导的整码突变效率还随着精准型NHEJ频率的提高而提高(图5)。其中的主要编辑组分是精准整码删除,同质性明显得以改良,这便于挑选等位基因精准整码删除的细胞克隆。
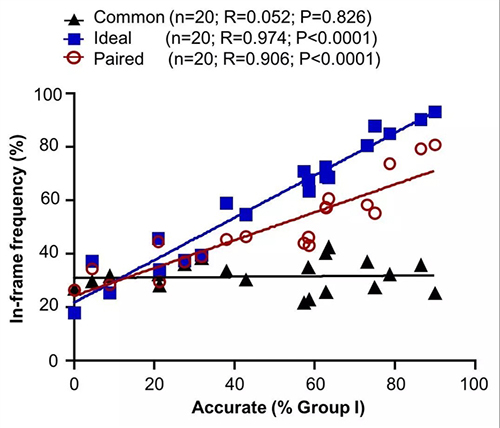
图5. 配对Cas9-sgRNA技术可以提高整码突变的编辑效率。
为了帮助配对Cas9-sgRNA的基因编辑效果,Plk3的小分子抑制剂GW843682X(图6a),该抑制剂可以阻碍末端加工,提高精准型NHEJ效率[5]。通常,精准型NHEJ的提高是以牺牲总编辑效率为代价的,有时总体上并不利于精准基因编辑。庆幸的是,GW843682X不仅不降低总编辑效率,反而提高(图6b)。这为提高配对Cas9-sgRNA的基因编辑效果提供了一个可以化学改良的机会。

图6. Plk3抑制剂GW843682X可以提高配对Cas9-sgRNA工作效能。
a. Plk3抑制剂提高精准型NHEJ效率。b. Plk3抑制剂提高Cas9-sgRNA的总编辑效率。
基于配对Cas9-sgRNA编辑特征,作者提出相应的基本操作流程及该技术需要遵循的几个原则(图7):1)需要从针对特定基因组靶点的多个sgRNA中快速筛选出有效的配对sgRNA;2)该技术适用于基因组DNA短片段删除,本文所测试的长度主要集中在12-148碱基对之间;3)配对Cas9-sgRNA 的PAM方向组合尽量选择W/C以避免高频的模板化插入;4)移码突变时配对Cas9-sgRNA切割间距设置为3n+1或3n+2碱基对(n为0或大于0的整数),但为避免高频的+1核苷酸模板化插入,尽量选择3n+2碱基对;5)整码突变时配对Cas9-sgRNA切割间距设置为3n碱基对(n为大于0的整数);6)必要时可以利用Plk3的小分子抑制剂GW843682X提高基因编辑效果。
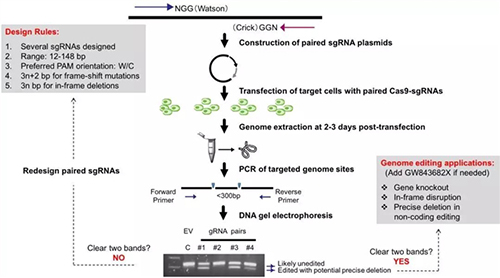
图7. 利用配对Cas9-sgRNA编辑策略进行基因编辑的流程图及需要遵循的原则。
本文中,配对Cas9-sgRNA技术被用于DNA损伤应答因子MDC1的精准移码删除(即精准基因敲除)以及53BP1的寡聚结构域(oligomerization domain,OD)和Tudor结构域的精准整码删除。作者从中获取等位基因精准编辑的细胞克隆,分析基因及对应结构域的功能,验证了配对Cas9-sgRNA基因编辑技术的应用潜力。随着PAM相容性的拓展,配对Cas9-sgRNA策略可以应用到更多的基因组靶点,应用将更广泛。