基于DNA编辑技术的治疗仍面临很多问题,目前CRISPR-Cas9基因编辑技术越来越成熟,研究人员已经可利用这种技术来治疗遗传性的线粒体疾病,美国研究团队已经开发出一种全新的基于 RNA 碱基编辑的基因疗法。

目前基于 DNA 碱基编辑的基因治疗通过引导guide RNA引领特殊的酶进行剪切,我们看不见DNA 双链,想要对 DNA 进行删除、替换和修改等操作,就必须有“指明灯”引导 RNA帮助。当整个 DNA 修改完毕后,便会自动进行转录翻译,最终发挥其生物学功能。但这也带来一些问题,比如当我们修改完所需的 DNA 后,无法进一步控制其表达情况,必须借助其他繁琐的步骤来控制其表达。
利用 RNA 编辑实现的基因疗法,不但可以可以有效的控制下游蛋白的表达情况还降低运载工具带来的免疫原问题,通过人工小分子药物对RNA转录进行调控。
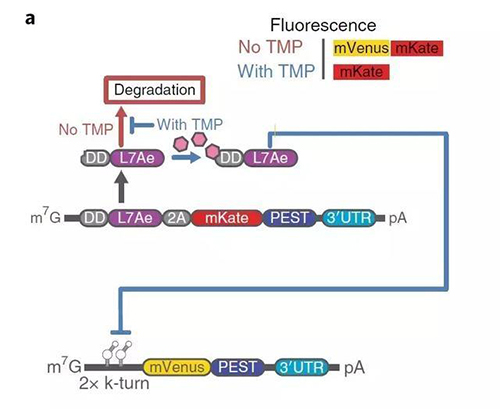
处于 OFF 开关的 RNA 编辑系统
DNA 控制 RNA 的转录,RNA 再翻译成蛋白质,最终展现生物学行为。在 RNA 翻译成蛋白质这一关键步骤中,一种名为 RBP的蛋白质对整个翻译过程起到至关重要的调控作用。因此,调控具有治疗效性的合成 RNA 序列需借助 RBP 转运。
他们究竟是如何实现这一复杂功能的呢?首先,Tasuku Kitada 研究团队筛选出对小分子药物敏感的 RNA 结合蛋白,当小分子药物存在时,RNA 结合蛋白处于激活状态,而当小分子物质不存在时,RNA 结合蛋白处于失活状态。激活状态的 RNA 结合蛋白则会有效与底物 RNA 相互作用,进而调控底物 RNA 的表达。
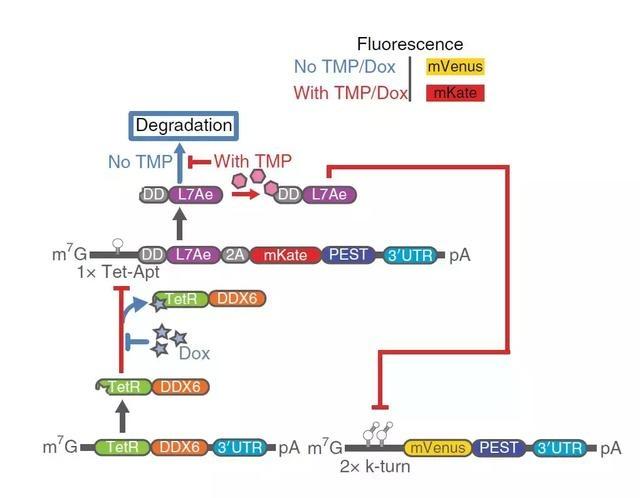
对两种不同 RNA 进行选择性表达
这一 RNA 环基因疗法还可以同时对两个基因的表达进行选择,可令临床医生对患者多个基因进行调控,更准确制定治疗方案,未来或许应用于临床肿瘤疾病的治疗。
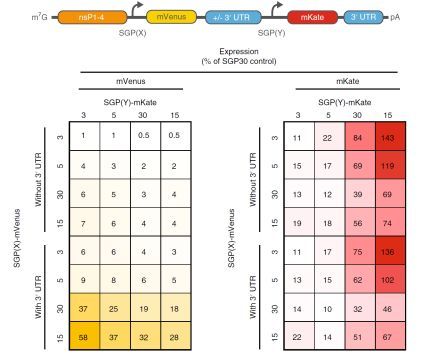
MIT 研究生 Jacob Becraft 表示,“由于 DNA 复制的动态性,导入的编辑 RNA 环可调控不同的蛋白质在不同时间表达,这使得目前的基因疗法存在较大的安全隐患。但随着他们研究的进行,将会开发出更加“智能”的编辑系统,进而提高整个基因治疗的安全性。”
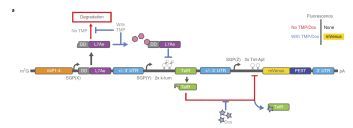
研究人员利用 RNA 编辑基因疗法,计划开发能够选择性刺激免疫细胞的 RNA 环,靶向治疗转移至抗肿瘤药物难以到达部位的肿瘤细胞。同时,临床医生可以选择性关闭那些原本致命的治疗性蛋白的表达,有效减少基因治疗并发症。